Il sapone è un acido o una base e come funziona?
Cos'è il sapone?
In chimica, sapone è un sale di a acido grasso . I saponi vengono utilizzati principalmente per lavaggio , fare il bagno , E pulizia . I saponi detergenti si ottengono trattando con forza oli e grassi vegetali o animali alcalino soluzione. Sono composti da grassi e oli trigliceridi ; tre molecole di acidi grassi sono attaccati ad una singola molecola di glicerolo . La soluzione alcalina, che viene spesso chiamata liscivia (sebbene il termine "sapone alla lisciva" si riferisca quasi esclusivamente ai saponi realizzati con idrossido di sodio ), determina a reazione chimica conosciuto come saponificazione . In questa reazione, i grassi trigliceridi vengono prima idrolizzati in acidi grassi liberi, quindi questi si combinano con gli alcali per formare sapone grezzo, un amalgama di vari sali di sapone, grasso in eccesso o alcali, acqua e acqua liberata. glicerolo (glicerina). La glicerina è un sottoprodotto utile, che può essere lasciato nel sapone come agente ammorbidente o isolato per altri usi.
Come funziona il sapone?
Il sapone è un ottimo detergente grazie alla sua capacità di agire come agente emulsionante. Un emulsionante è in grado di disperdere un liquido in un altro liquido immiscibile. Ciò significa che mentre l'olio (che attira lo sporco) non si mescola naturalmente con l'acqua, il sapone può sospendere l'olio/sporco in modo tale da poterlo rimuovere.
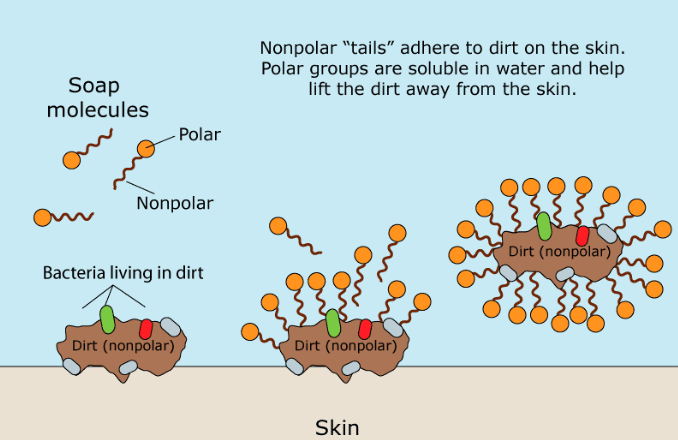
La parte organica del Sapone naturale è una molecola polare caricata negativamente. Il suo gruppo carbossilato idrofilo (amante dell'acqua) (-CO2) interagisce con le molecole d'acqua tramite interazioni ione-dipolo e legami idrogeno. La parte idrofobica (che teme l'acqua) di una molecola di sapone, la sua lunga catena di idrocarburi non polari, non interagisce con le molecole d'acqua. Le catene di idrocarburi sono attratte l'una dall'altra dalle forze di dispersione e si raggruppano formando strutture chiamate micelle. In queste micelle, i gruppi carbossilato formano una superficie sferica carica negativamente, con le catene di idrocarburi all'interno della sfera. Poiché hanno carica negativa, le micelle di sapone si respingono e rimangono disperse nell'acqua.
Il grasso e l'olio sono apolari e insolubili in acqua. Quando il sapone e gli oli sporchi vengono miscelati, la porzione idrocarburica non polare delle micelle rompe le molecole di olio non polari. Si forma quindi un diverso tipo di micella, con molecole di sporco non polari al centro. Pertanto, il grasso, l'olio e lo "sporco" ad essi attaccato vengono catturati all'interno della micella e possono essere risciacquati.
Il sapone è un acido o una base?
Il sapone non è completamente un acido o una base, è un sale basico. È una combinazione di acido debole e base forte. Quando un acido e una base si combinano in una certa quantità, formano sale e acqua. E quando il sale ha una base più forte nella sua combinazione, mostra la natura fondamentale.
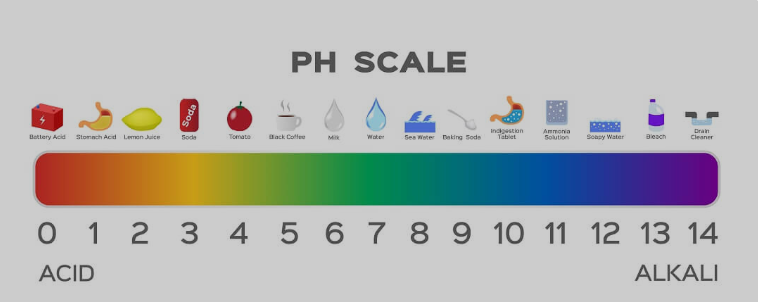
Il sapone è un acido/base forte o debole?
Il sapone ha una natura di base debole. Sebbene durante la produzione dei saponi vengano utilizzate basi forti, gli acidi deboli utilizzati nella reazione ne neutralizzano in una certa misura gli effetti. Quando si utilizza una striscia di pH per misurare, la maggior parte dei saponi mostra un pH di 9-10. Mentre le basi forti vanno da 12 a 14 sulla scala del pH.