Quando è stato inventato il sapone te lo dico
Cos'è il sapone, ufficialmente?
Gran parte della confusione con la definizione ufficiale avviene tra true sapone e detergenti sintetici – quelli che la FDA chiama “detergenti”. Il vero sapone, o sapone ordinario, è definito come la “combinazione di grassi o oli con un alcali, come la liscivia”. Molte di quelle barre sugli scaffali, e molte di quelle bottiglie con una pompa, non sono affatto sapone, ma un mix di sintetici, molti dei quali inclusi per compensare la natura essenziale dei detersivi.
La FDA non fa alcuna distinzione tra sapone fatto con grassi vegetali e sapone fatto con sego. Non fanno alcun tentativo di definire il sapone organico. C'è un compito semplice. Anche la regolamentazione del sapone spetta a un altro ente governativo, la Consumer Products Safety Commission. Tuttavia, non sono solo gli ingredienti a determinare se un prodotto rientra nella definizione normativa di sapone. Ci sono altre due variabili da considerare. Ecco una pratica definizione in tre punti:
- Ingredienti. Per essere regolamentato come sapone, un prodotto deve essere composto principalmente da “sali alcalini degli acidi grassi”, ovvero ciò che si ottiene quando si combinano gli acidi grassi con la lisciva.
- Come pulisce. I “sali alcalini degli acidi grassi” devono essere l'unico ingrediente che svolge un'azione pulente. Se i sintetici aggiunti giocano un ruolo, il prodotto non è più un sapone, ma un cosmetico.
- La sua destinazione d'uso. Per essere regolamentato come sapone, un prodotto deve essere etichettato e commercializzato solo come sapone. Se la sua intenzione è idratare la pelle, deodorare la pelle o farla profumare, non è più un sapone, ma un cosmetico. Se è destinato a curare l’eczema o a prevenire le malattie uccidendo i germi, non è più sapone. È ufficialmente una droga.

Quando è stato inventato il sapone
I documenti mostrano che il sapone veniva prodotto già nel 2800 a.C. dagli antichi babilonesi, ma il sapone divenne particolarmente popolare durante l'era vittoriana, quando la produzione di massa divenne fattibile in seguito alla rivoluzione industriale. Ciò, combinato con una crescente comprensione delle pratiche sanitarie e della pubblicità per incoraggiare il bagno con il sapone, fece sì che l’umile saponetta diventasse rapidamente un oggetto domestico essenziale.

Qual è la formula del sapone
Da secoli gli esseri umani conoscono la ricetta base del sapone: è una reazione tra i grassi e una base forte. La formula chimica esatta è C17H35COO- più un catione metallico, Na+ o K+. La molecola finale si chiama stearato di sodio ed è un tipo di sale. A seconda del catione metallico, i saponi sono sali di potassio o sali di sodio disposti come acidi carbossilici a catena lunga.
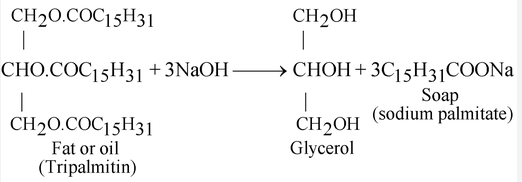
In genere, la formazione di queste catene comporta la combinazione dell'idrossido di potassio con un grasso animale o vegetale o talvolta con l'acido acetico. Una molecola di sapone fa due cose: si lega sia all’acqua che ai detriti. Ciò è dovuto ai suoi componenti idrofili, o “amanti dell’acqua”, e idrofobici, o “timorosi dell’acqua”. Una molecola di sapone ha una "testa" anionica idrofila e una "coda" idrofobica costituita da idrocarburi. La testa delle molecole viene attratta e si dissolve in acqua, mentre la coda degli idrocarburi è attratta dallo sporco e dal grasso e respinta dall'acqua.
Anche il sapone è un tensioattivo: riduce la tensione superficiale dell'acqua. L'acqua ha una forte tensione superficiale , che fa sì che le gocce si depositino su una varietà di superfici, dal metallo al tessuto. Ciò rallenta il processo di bagnatura dell'acqua e inibisce la sua capacità di pulire. Poiché i saponi riducono la tensione superficiale dell'acqua, questa può diffondersi e bagnarsi più facilmente. Inoltre, i tensioattivi sciolgono ed emulsionano lo sporco e i detriti, disperdendoli in acqua e consentendone il risciacquo.
Oggi, il processo di produzione del sapone prevede più comunemente la reazione di un acido organico con sostanze chimiche alcaline come l'idrossido di potassio o l'idrossido di sodio. A livello industriale, la base di soda caustica utilizzata più spesso è l'idrossido di sodio, chiamato anche lisciva. La differenza principale tra i saponi di potassio e quelli di sodio è la consistenza: di solito, il potassio produce un sapone più morbido e più solubile in acqua rispetto al sodio.
Come funziona il sapone?
Il sapone è in grado di pulire mani e piatti grazie ad una chimica piuttosto ingegnosa. Le molecole di sapone hanno su un’estremità quello che è noto come sale polare, che è idrofilo o attratto dall’acqua. L'altra estremità della molecola è una catena non polare di acidi grassi o idrocarburi, che è idrofobica, ovvero è respinta dall'acqua ma attratta dal grasso e da altre sostanze oleose. Quando ti lavi le mani, il sapone forma una sorta di ponte molecolare tra l'acqua e gli oli sporchi e carichi di germi sulle tue mani, attaccandosi sia agli oli che all'acqua e sollevando e allontanando lo sporco. I saponi possono anche connettersi con le membrane grasse esterne dei batteri e di alcuni virus, sollevando gli agenti infettivi e persino rompendoli. Una volta che lo sporco oleoso e i germi si sono allontanati dalle mani, le molecole di sapone le circondano completamente e formano minuscoli grappoli, noti come micelle, che impediscono loro di attaccarsi a qualsiasi altra cosa mentre vengono lavate nello scarico.